Сульфиды: Станнин
 Диагностическая карта.
Диагностическая карта.
Cu2 Fe Sn S4
Сингония тетрагональная
Твердость
Удельный вес
4,3-4,5
Спайность
несовершенная
Излом
неправильный, хрупкий
Цвет
серый
Цвет
в порошке
серый
Блеск
металлический
Станнин (оловянный колчедан), - сульфид меди, олова и железа. Блеск металлический с тусклой побежалостью. Непрозрачен. Цвета: от серо-стального до оливково-зеленого. Черта черная. Излом неровный. Хрупок. Спайность несовершенная. Встречается в оловорудных месторождениях. Кристаллы (тетрагональной сингонии) весьма редки и невелики. Обычно встречаются плотные агрегаты, тонкозернистые до сливных. Входит в состав оловянных руд. Места распространения: Германия, Чехия, Англия, СНГ, Тасмания, Боливия.
Цвет стально-серый с голубоватым отблеском. Встречается редко в гидротермальных жилах или в пегматитах вместе с кассите ритом, вольфрамитом и сульфидами. Форма кристаллов псевдокубическая, но в основном минерал встречается в виде тонкозернистых скоплений. Его также называют боливианитом, или оловянным пиритом.
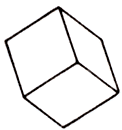
Химический состав. Медь (Сu) 29,5%, железо (Fe) 13,1%, олово (Sn) 27,5%, сера (S) 29,9%. Форма кристаллов. Псевдокубические, псевдотетраэдрические. Кристаллическая структура. Аналогична структуре халькопирита. Класс симметрии. Тетрагояально-скаленоэдрический — 42m Спайность. Несовершенная по (001), (110). Агрегаты. Плотные.
Диагностические признаки.
Минерал мягкий, легко
царапается кончиком ножа. Плавится, на угле образует белый налет.
Поведение в кислотах. Растворяется в НNОз с выделением серы и двуокиси олова.
Происхождение.
Встреча
ется в оловоносных жилах с
касситеритом, тетраэдритом
и пиритом.
Месторождения.
Главные места, где распространен станнин: Этта-Майн в Южной Дакоте и полуостров Сьюард на Аляске (США); Ллялагуа в департаменте Оруро (Боливия), Циновец (Циннвальд) в Республике Чехия, Зиэн в Тасмании, Уиэл-Рок в Корнуэлле.

Станнин. Мушистон м-ние, Зеравшанский хр., Таджикистан, СНГ. Фото: © А.А. Евсеев.
Олово (Sn) латинское Stannum, обозначается Sn - элемент с атомным номером 50 и атомным весом 118,69. Является элементом главной подгруппы четвертой группы, пятого периода периодической системы химических элементов Д. И. Менделеева. Олово при нормальных условиях - мягкий, ковкий, пластичный металл серебристо-белого цвета. Обладая высокой мягкостью и тягучестью, олово может быть прокатано в тонкие листы, которые называют оловянной фольгой или станиолем.
Природное олово состоит из девяти стабильных изотопов с массовыми числами 112Sn (в смеси 0,96 % по массе), 114Sn (0,66 %), 115Sn (0,35 %), 116Sn (14,30 %), 117Sn (7,61 %), 118Sn (24,03 %), 119Sn (8,58 %), 120Sn (32,85 %), 122Sn (4,72 %). Десятый изотоп олова 124Sn (5,94 %) - слабо радиоактивен, является ?-излучателем и имеет период полураспада 1016-1017 лет. Изотопы олова 117Sn и 119Sn являются мессбауэровскими изотопами и применяются в гамма-резонансной спектроскопии. Еще 15 изотопов олова с массовыми числами 108...111, 113, 121, 123, 125...132 получены искусственно. Время жизни этих изотопов далеко не одинаково. Так, 123Sn имеет период полураспада 136 дней, а 132Sn всего 2,2 минуты. Пятидесятый элемент обладает наибольшим числом стабильных изотопов, что связано с тем фактом, что 50 (число протонов в ядрах олова) является "магическим числом" - оно составляет заполненную протонную оболочку в ядре и повышает тем самым энергию связи и стабильность ядра.
Олово наряду с золотом, серебром, свинцом, медью, ртутью и железом относится к элементам, известным человечеству с глубокой древности. Определить точную дату ознакомления человечества с этим металлом сложно, можно сказать, что сплавы олова с медью - бронзы были известны уже в IV тыс. до н. э., а чистый металл во II тыс. до н. э. Из чистого олова в древности изготовляли посуду и украшения, очень широко применяли изделия из бронзы. Предполагается, что металл был малодоступен и весьма дорог, так как изделия из него редко встречаются среди римских и греческих древностей (не хранятся - объект вандализма). Латинское название stannum, связанное с санскритским словом, означающим "стойкий, прочный".
Сплавы олова с сурьмой и медью применяются для изготовления подшипников. Эти сплавы - оловянные баббиты обладают высокими антифрикционными свойствами. Другие сплавы олова - со свинцом (припои) широко применяются для пайки. Кроме того, олово используется в качестве легирующего компонента. Олово применяют для нанесения защитных покрытий на железо и другие металлы, а также на металлические изделия (лужение). Двуокись олова - очень эффективный абразивный материал, применяемый при "доводке" поверхности оптического стекла. Олово применяется также в химических источниках тока в качестве анодного материала. Одно из самых главных промышленных применений олова - использование в белой жести (луженое железо) для изготовления тары пищевых продуктов. Ранее олово часто использовалось, как художественный материал в декоративно-прикладном искусстве.
Токсичность олова и большинства его неорганических соединений невелика (есть - с возрастом). Однако органические соединения олова, особенно ди- и триалкильные, обладают выраженным действием на центральную нервную систему. У рабочих оловоплавильных заводов при длительном воздействии пыли окиси олова (так называемое черное олово, SnO) могут развиться пневмокониозы, у рабочих, занятых изготовлением оловянной фольги, отмечаются случаи хронической экземы. Тяжелые отравления, вызванные употреблением в пищу давно изготовленных консервов, могут быть связаны с образованием в консервных банках SnH4 (за счет действия на полуду банок органических кислот содержимого).
Биологические свойства. О роли олова в организме известно немного (заменитель натрия Na, соленое). Установлено лишь то, что дефицит олова сопровождается замедлением роста и привеса, нарушением минерального состава внутренних органов, ухудшением слуха. Такое возможно при малом поступлении олова в организм - 1 мг/день и менее. В человеческом теле содержится примерно 2*10–4 % олова. Основной источник поступления олова в человеческий организм - пища, с которой поступает порядка 0,2-3,5 мг в сутки. Так наименьшая концентрация олова в молоке и свежих овощах (примерно 1 мкг/г и менее), зато в жирах (особенно жирной рыбе) содержание этого металла весьма высоко и может доходить до 130 мкг/г.
Многие растения способны аккумулировать олово, содержащееся в почве, воде, в выхлопных газах автомобилей. Так, брусника и черника, собранные в лесу, расположенном даже в 25 км от автострад с большим движением, содержат около 40 мг олова на 1 кг ягод при норме 2 мг/кг. В пищевые продукты пятидесятый элемент может попадать и из упаковки - упаковочная фольга или консервные банки. В течение суток оптимальной дозой поступления олова в организм считают от 2 до 10 мг. Основной вид содержания данного металла в теле человека - в виде жирорастворимых солей. В тканях олово присутствует в концентрациях от 0,5 до 4,0 мкг/г. На кости приходится 0,8 мкг/г олова, на почки, сердце и тонкий кишечник - 0,1 мкг/г. Выделяется олово из организма с желчью и мочой.
Несмотря на то, что недостаток олова приводит к ряду заболеваний, его избыток гораздо вреднее для человеческого организма (как и натрия Na). Олово не относится к особо токсичным металлам (металлическое олово не ядовито), однако представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли (при воздействии паров или пыли олова может развиться станноз - поражение легких). Очень токсичны некоторые оловоорганические соединения, которые при поступлении в желудочно-кишечный тракт проявляют выраженный кумулятивный эффект с последующим развитием хромосомных аберраций в клетках костного мозга (похож на натрий, Na, употребляют поваренную соль NaCl).
При избыточном поступлении олово накапливается в печени, почках, скелете и мышцах. У рабочих оловоплавильных заводов при длительном воздействии пыли окиси олова (так называемое черное олово) SnO могут развиться пневмокониозы; у рабочих, занятых изготовлением станиоли, иногда отмечаются случаи хронической экземы. Считается, что содержание в крови этого металла в количестве 35 мг на 100 мл может вызвать функциональные изменения центральной нервной системы. Тетрахлорид олова (SnCl4*5H2O) при концентрации его в воздухе свыше 90 мг/м3 раздражающе действует на верхние дыхательные пути, вызывая кашель; попадая на кожу, хлорид олова вызывает ее изъязвления.
Сильный судорожный яд - оловянистый водород (станнометан) SnH4. Тяжелые отравления при употреблении в пищу давно изготовленных консервов связаны с образованием в банках именно этого яда - SnH4. При острых отравлениях оловянистым водородом характерны судороги, нарушение равновесия, в некоторых случаях возможен летальный исход. Во многом степень отравления зависит от индивидуальной переносимости: у детей и пожилых людей отравление даже небольшим количеством олова может быть фатальным.
Главные проявления избытка олова: постоянные головные боли; головокружения; расстройства зрения; металлический привкус во рту; тошнота; снижение аппетита; боли в животе; увеличение печени и прочие признаки. На основании лишь этих симптомов трудно предположить, что причиной их появления служит загрязнение воздуха и воды пятидесятым элементом или его соединениями. Верными признаками отравления являются кишечные колики, сине-черная обводка десен, бледно-серый цвет кожи, малокровие. Дополнительную информацию может дать анализ крови, указывающий на повышение уровня трансаминаз в крови, снижение содержания в организме цинка и меди.
Профилактикой отравлений оловом могут служить соблюдения правил гигиены труда, контроль предельно допустимых концентраций соединений пятидесятого элемента. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках - 100 мг/кг. Кроме того, не стоит пользоваться посудой, содержащей олово и кадмий; необходимо строить дома вдали от дорог и магистралей. Живущим вблизи шоссе необходимо профилактически строго следить за тем, чтобы дети и взрослые получали с пищей достаточно магния, железа, кальция, цинка и витаминов.
Интересные факты. В ходе исследований американские ученые, подвергшие исследованию кости (возраст которых составил 1600 лет) североамериканских индейцев установили, что содержание олова в них в 700-1200 раз меньше, чем у современных жителей США и Австралии. Основываясь на этих данных, американский историк медицины Сибэри Дж. Джилфиллан выдвинул гипотезу, что Рим пал не только из-за свинца, но и из-за олова! Известен тот факт, что древние римляне употребляли много вина, которое подслащивали соком винограда (своего рода сиропом). Для приготовления этого сиропа использовали оловянные котлы, металл проникал в вино, отравляя жителей "вечного города". Способ приготовления подслащенного вина перекочевал и в некоторые европейские страны, где монахи готовили вино в такой же посуде. Известно, что в Средневековье одной из самых распространенных болезней монахов, которые любили попивать вино, была так называемая кишечная колика. Только в VII веке выяснилось, что причиной колики являлось олово. Д
ома у оживленных автомагистралей - частое явление современного урбанизированного общества. Исследования показали, что в жилых помещениях, расположенных на расстоянии не более полукилометра от автострады, содержится избыток олова. Источник данного металла - канцерогенная пыль от автомобильных шин и выхлопные газы. Накапливаясь в теле человека, олово создает условия для появления злокачественных заболеваний. Отсюда появилось выражение "раковые дома".
Мировое производство олова достигает в настоящий момент около 3,3 млн. тонн в год. Из них более четверти миллиона тонн попадает в атмосферу в виде выхлопных газов! В начале XX века (1912 год) погибла отправившаяся на штурм Южного полюса экспедиция Скотта. Люди, оставшиеся без горючего, замерзли во льдах. Керосин просочился через запаянные оловом баки, пораженные "оловянной чумой". Явление полиморфного превращения "белого олова" в "серое" было известно давно (на складах многих армий рассыпались в пыль оловянные пуговицы на шинелях и котелки из того же материала). Однако суть самого процесса была раскрыта лишь в 1911 году Г. Коэном, выяснившем, что развивается это явление только в условиях низких температур - быстрее всего процесс идет при –33 oC. Причем, если зараженные вещи соседствуют с целыми, происходит "инфицирование" здорового металла, прямо как при настоящей "человеческой" чуме.
"Оловянная чума" была случайным "союзником" русской армии в ходе боевых действий 1812 года - лютые морозы привели к превращению оловянных пуговиц на мундирах французских солдат в порошок. "Оловянная чума" погубила многие ценнейшие коллекции оловянных солдатиков. Так, в запасниках петербургского музея Александра Суворова превратились в труху десятки оловянных фигурок - в подвале, где они хранились, лопнули зимой батареи отопления.
Морозной зимой 1916 года партия олова была отправлена по железной дороге с Дальнего Востока в европейскую часть России. К удивлению, получающих груз, на место прибыли не серебристо-белые слитки, а преимущественно мелкий серый порошок.
Одним из средств предотвращения "оловянной чумы" является добавление в олово стабилизатора, например висмута. В связи с малым содержанием олова в недрах Земли, производится разработка даже самых бедных и необычных оловосодержащих руд. Например, в 1976 году начало работать предприятие, которое сокращенно называют РЭП (разведочно-эксплуатационное предприятие), размещаемое, в основном на кораблях. За Полярным кругом, в море Лаптевых, в районе Ванькиной губы РЭП добывает с морского дна оловоносный песок. Здесь же, на борту одного из судов, работает обогатительная фабрика.
Основной машиностроительный сплав - бронза, на многих языках звучит очень сходно. Это связывают с названием небольшого итальянского порта на берегу Адриатического моря - Бриндизи. Именно через этот порт доставляли бронзу в Европу в старину, и в древнем Риме этот сплав называли "эс бриндиси" - медь из Бриндизи.
Химические источники тока, в роли анодного материала в которых используют оловянные сплавы (марганцево-оловянный элемент, окисно-ртутно-оловянный элемент), при равном напряжении (со свинцовыми аккумуляторами) обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объема, внутреннее сопротивление его значительно ниже.
История. Олово - один из семи металлов древности (как и золото, серебро, свинец, медь, ртуть и железо), то есть один из немногих металлов, известных человеку еще с доисторических времен. Олово наряду с медью были открыты раньше железа! Упоминание об олове есть в ранних книгах Ветхого Завета (Четвертой Книге Моисеевой), об олове в своих трудах говорит и Гомер. Сплав этих двух металлов - бронза, вероятнее всего, самый первый материал "искусственно приготовленный" человеком. Ряд археологических находок позволяет предположить, что еще за пять тысячелетий до нашей эры люди умели выплавлять и само олово. Так в Древнем Египте из олова, доставляемого из Персии, выполнялись украшения (олово наплавлялось на другие металлы) и предметы обихода (в основном посуда), кроме того, олово шло на изготовление бронзы. В Египте, Месопотамии и других странах древнего мира бронза из олова изготовлялась уже в III тысячелетии до н. э.
Большинство стран древнего мира не имело собственных богатых оловянных рудников. Поэтому металл ввозился морским путем с территории Пиренейского полуострова, а также с Кавказа и из Персии, при этом его часто путали со свинцом. Финикийцы почти за десять веков до новой эры доставляли оловянную руду с Британских островов, называвшихся тогда Касситеридами. Возможно, именно отсюда и происходит название касситерита - важнейшего из минералов олова (SnO2). Таким образом, можно проследить эволюцию данного названия металла - древнегреческое название олова "касситерос" восточного происхождения и, несомненно, связано с аккадским названием олова "ик-касдуру", ассирийским "казазатира" и поздневавилонским "кастера".
Латинское название олова (Stannum или Stagnum) вошло в употребление в Риме в императорский период (Юлий Цезарь). По одному из предположений данное название связано с санскритским "stha" (стоять, стойко держаться) или "sthavan" (прочно, стойко). В тоже время слово "stagnum" на латинском языке означает "стоячую воду", "пруд", "озеро" и даже "море" (в переносном смысле). Как говорилось ранее, олово нередко считали видоизменением свинца и в средневековье называли белым (Plumbum album) или блестящим (Plumbum candidum) свинцом в отличие от обыкновенного черного свинца (Plumbum nigrum). Английское "tin", немецкое "zinn" и французское олово "etain" берут свое начало в древнегерманском языке и происходят от слова "zein" - палочка или пластинка.
Существует, как минимум, две теории о происхождении русского слова "олово". Согласно первой - индогерманской теории происхождения языков - "олово" и созвучные с ними литовское "alavas", "alvas" и прусское "alwis" (свинец) произошли от латинского "album", фигурирующего в средневековом названии олова Plumbum album. По такому же принципу слово Cuprum производится от Aes cyprium. По другой версии (более правдоподобной) русское "олово" и польское "olow" (свинец) имеют функциональное происхождение. Дело в том, что славянские народы употребляли хмельной напиток (наподобие пива или браги) из ячменя и жита, этот напиток назывался "оловина" или "ол".
Вполне возможно, что оловина хранилась в сосудах из олова. Либо подобно римлянам, которые выдерживали и хранили вино в сосудах из свинца, славяне держали свой хмельной напиток в свинцовых кувшинах, а ведь в славянских странах свинец называли оловом. Также слово олово можно связать с названием другого жидкого тела - масла (oleum). С лингвистической точки зрения слово "олово" является суффиксальным образованием от корня ol- (ср. древневерхненемецкое elo - "желтый", лат. albus - "белый"), получается, что металл назван по цвету. В словаре Срезневского приводятся родственные олову слова - оловце (свинцовая лампада) и оловяник (сосуд из олова).
Нахождение в природе. Олово - достаточно редкий и рассеянный элемент, по распространенности в земной коре олово занимает сорок седьмое место. Среднее содержание олова в земной коре составляет, по разным данным, от 2*10–4 до 8*10–3 % по массе. Дело в том, что олово - это элемент в основном характерный для верхних слоев земной коры, его содержание в литосфере 2,5*10–4 % (по массе), в кислых изверженных породах 3*10–4 %, а в более глубоких основных 1,5*10–4 %; еще меньше олова содержит земная мантия.
Пятидесятый элемент проявляет амфотерные свойства (и кислотные и основные). Во многом именно это качество олова и влияет на его распространение в природе - данный дуализм выявляет литофильные, халькофильные и сидерофильные свойства этого металла. Пятидесятый элемент периодической таблицы по свойствам напоминает кварц, вследствие чего известна тесная связь олова в виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащенными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Что касается щелочных свойств олова, то они проявляются в образовании весьма разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Основные концентрации олова связаны с магматическими процессами (группа интрузивных и эффузивных магматических пород: "оловоносные граниты", траппы, пегматиты, пикриты Сибирской платформы, гипербазиты и габброиды Камчатки, кимберлиты Якутии, лампроиты Алдана, гранитоиды Приморья, Дальнего Востока, Тянь-Шаня). А также с гидротермическими процессами (группа метасоматически и гидротермально измененных пород: медно-никелевые руды Сибирской платформы, золоторудные объекты Урала, Кавказа, Узбекистана). Кроме того, олово встречается и в ряде других геологических образований, например, в осадочных породах различного происхождения или в современных очагах рудообразования - пелагические осадки Тихого океана, гидротермальная система Узон на Камчатке.
Так или иначе, а из 24 известных минералов олова 23 образовались при высоких температурах и давлениях. Главный в промышленном отношении минерал олова - касситерит (оловянный камень) SnO2, который является окисным соединением олова с кислородом. Касситерит содержит до 78,8 % олова, образует отдельные вкрапления, зерна, сплошные массивные скопления, в которых зерна минерала достигают в размере 3 - 4 мм и более. Основные месторождения касситерита в России расположены в Приморье, Забайкалье, Якутии. Кроме того, богатые запасы этого минерала расположены в Таиланде, КНР, Малайзии, Нигерии, Боливии, Индонезии и других странах.
Промышленные концентрации в рудах образует станин (оловянный колчедан) - минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Минерал содержит 29,58 % меди, 12,99 % железа, 27,5 % олова и 29,8 % серы, а также примеси цинка, сурьмы, кадмия, свинца и серебра. Станин - широко распространенный минерал в оловорудных месторождениях России, однако часто не используется из-за трудности его обогащения и извлечения из него олова. Кроме станина существуют и другие сульфидные соединения олова - берндтит SnS2, франкеит Pb5Sn3Sb2S14, герценбергит SnS, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Обнаружены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Некоторое промышленное значение может иметь кальциевый борат олова - норденшельдин (43,5 % олова).
Второстепенное место занимают гидроокисные соединения олова, их можно считать солями полиоловянных кислот. К ним можно отнести следующие минералы: сукулаит Ta2Sn2O, твердый раствор олова в магнетите вида Fe2SnO4 или Fe3SnO3, варламовит - продукт окисления станина. Известны также гидратированные продукты окисления - гидромартит 3SnOxH2O; мушистонит (Cu,Zn,Fe)Sn(OH)6; гидростаннат меди CuSn(OH)6. Из других окисных соединений известны также шпинелиды, например, минерал нигерит Sn2Fe4Al16О32.
Известна многочисленная группа силикатов олова, представленная малаяитом CaSn[SiO5]; пабститом Ba(Sn, Ti)Si3O9, стоказитом Ca2Sn2Si6O18x4H2O. Малаяит образует даже промышленные скопления. В биосфере олово мигрирует слабо, в морской воде его содержание лишь 3*10-7 %. В незагрязненных поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограмм на дм?, увеличиваясь в районе оловорудных месторождений.
Крупнейшие мировые месторождения олова расположены в Юго-Восточной Азии (Китай, Индонезия, Таиланд, Малайзия). Существуют крупные месторождения олова в Южной Америке (Бразилия, Перу, Боливия) и Австралии. Богатые оловянные месторождения России расположены в Чукотском автономном округе, Якутии, Приморском крае, Хабаровском крае и других районах.
Применение. Одна из основных областей применения олова обусловлена тем, что этот металл является относительно безопасным, нетоксичным, коррозионностойким покрытием, как в чистом виде, так и в сплавах с другими металлами. По этим причинам главное промышленное применение пятидесятого элемента - изготовление белой жести (луженого железа) для производства тары пищевых продуктов, которая используется в консервной промышленности. На эти нужды расходуется порядка 33 % всего добываемого олова. Еще большее количество этого металла (60 %) расходуется в металлургии на создание различных сплавов, важнейший из которых - бронза (сплав олова с медью). Этот сплав один из незаменимых материалов в области машиностроения.
Техника нуждается и в других оловянных сплавах, довольно часто их применяют в качестве антифрикционных материалов, которые позволяют увеличить ресурс машин и механизмов. Из всех антифрикционных сплавов наилучшими свойствами обладают оловянные баббиты (подшипниковые сплавы олова с сурьмой), в составе которых до 90 % олова. Припои - оловянные сплавы (с цинком либо свинцом) с помощью которых возможно соединять металлические детали. Мягкие и легкоплавкие свинцово-оловянные припои хорошо смачивают поверхность большинства металлов, обладают высокой пластичностью и сопротивлением усталости, а нетоксичные цинко-оловянные припои прекрасно подходят для лужения посуды и других бытовых изделий. К сожалению, область применения оловянных припоев ограничивается из-за недостаточной механической прочности.
Другой известный сплав - пьютер - используется для изготовления посуды (опасно). Олово входит также в состав типографского сплава гарта (черный, газеты, СМИ). Наконец, сплавы на основе олова необходимы в электротехнике. Важнейший материал для электроконденсаторов - станиоль - тонкая оловянная фольга, в которой доля прочих элементов менее 5 %. Кроме конденсаторов станиоль идет на изготовление органных труб, посуды, художественных изделий. Олово является основным легирующим компонентом при получении конструкционных сплавов титана. Интерметаллические соединения олова обладают высокими температурами плавления, так, например, станнид циркония Zr3Sn2 плавится лишь при температуре 1 985 oC, при этом сплав обладает стойкостью к окислению при нагревании на воздухе.
Другой пример тугоплавкости оловянного сплава - соединение Mg2Sn с температурой плавления 778 oC. Сам по себе магний плавится при 651 oC - не самая высокая температура плавления, олово плавится при еще меньшей температуре - 232 oC. "Секрет" заключается в характере сплава, а точнее в химической связи между образующими его веществами. Из неметаллических соединений олова наибольшее значение имеют хлориды. Например, тетрахлорид олова SnCl4 применяется в качестве растворителя, так как способен растворять йод, фосфор, серу и многие органические вещества.
В текстильном производстве используется дихлорид олова SnCl2, который применяется для протравы при крашении и в качестве восстановителя при синтезе органических красителей. Этими же качествами обладает и другое неметаллическое соединения олова - станната натрия Na2SnO3, имеющий и дополнительную функцию - утяжеление шелка. Смесь солей олова - "желтая композиция" - когда-то использовалась как краситель для шерсти. Дисульфид олова SnS2 (золотисто-желтые кристаллы) применяют в составе красок, имитирующих позолоту ("сусальное золото"). Ограниченно используются окислы олова, например двуокись олова SnO2 - очень эффективный абразивный материал, применяемый при "доводке" поверхности оптического стекла, а также SnO2 используется при производстве белой глазури. Оксид олова SnO используется для получения рубинового стекла. Станнат бария BaSnO3 нашел свое применение в радиотехнике в качестве превосходного диэлектрика.
Не менее широкое применение в различных областях нашли и оловоорганические соединения. В связи с тем, что многие из них токсичны, их широко используют в сельскохозяйственной промышленности в качестве инсектицидов (яды). Так, например, на базе ацетата трифенилолова (C6H5)3SnOOCCH3 был создан эффективный препарат для борьбы с грибковыми заболеваниями таких важных сельскохозяйственных культур, как картофель и сахарная свекла, а также это вещество стимулирует рост и развитие растений.
В ветеринарии для борьбы с гельминтами применяются препараты на основе дилаурината дибутилолова (C4H9)2Sn(OCOC11H23)2, кроме того, дибутилоловодилаурат - стабилизатор ПВХ, катализатор в производстве полиуретановых пен. Препараты, борющиеся с паразитическими организмами, на основе оловоорганики использует не только сельское хозяйство. Гидроокись трибутилолова (С4Н9)3SnOH применяют в целлюлозно-бумажной промышленности для борьбы с грибками, развивающимися в аппаратах переработки. Благодаря этому соединению значительно повышается производительность аппаратуры.
Производство. Промышленное получение олова целесообразно, если содержание его в россыпях 0,01 %, в рудах 0,1 %. Олову в рудах часто сопутствуют вольфрам, цирконий, цезий, рубидий, редкоземельные элементы, тантал, ниобий и другие ценные металлы. Оловянные руды редко содержат больше 1 % олова. Что интересно, в прошлом люди располагали более богатыми оловянными рудами, чем мы. Металл выплавляли из руд, непосредственно находящихся на поверхности земли (искали бирюзу). Обогащение происходило естественным путем - за счет выветривания и вымывания. К сожалению, до наших времен такие мало руды не сохранились, поэтому в современных условиях процесс получения олова многоступенчатый и трудоемкий, и начинается он с обогащения руд и россыпей.
Методы обогащения оловянных руд весьма разнообразны (ГОКи). Применяют, в частности, гравитационный метод, основанный на различии плотности основного и сопутствующих минералов (ГОК). При этом рудоносная порода подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных дробильных машинах (мельницах), после чего касситерит (оловоносный минерал) за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационном методом на обогатительных столах. В дополнение применяется флотационный метод обогащения (очистки) руды и/или метод магнитной сепарации.
В тех случаях, когда оловоносная руда содержит ценные металлы (вольфрам, тантал и прочие), их пытаются отделить при обогащении. Состав полученного оловянного концентрата зависит от перерабатываемого сырья, и еще от того, каким способом этот концентрат получали. Содержание олова в нем колеблется от 40 до 70 %. После процессов обогащения, концентрат направляют в печи для обжига (при температуре 600...700 oC) в кислороде для удаления летучих примесей серы и мышьяка. Большую часть железа, сурьмы, висмута и некоторых других металлов уже после обжига выщелачивают соляной кислотой HCl. При наличии примесей вольфрамита (Fe, Mn)WO4 и шеелита CaWO4, концентрат обрабатывают HCl, образовавшуюся WO3*H2O извлекают благодаря NH4OH. Плавкой концентратов с углем в электрических или пламенных печах получают черное олово (94-98 % Sn), содержащее примеси меди, свинца, железа, мышьяка, сурьмы, висмута.
При выпуске из печей черновое олово фильтруют через кокс или центрифугируют при температуре 500-600 oC, отделяя этим основную массу железа. С физико-химической точки зрения этот процесс аналогичен доменному: углерод "отнимает" у олова кислород, а флюсы превращают двуокись кремния в легкий по сравнению с металлом шлак. Остаток железа и меди удаляют добавлением в жидкий металл элементарной серы, при этом примеси всплывают в виде твердых сульфидов, которые снимают с поверхности олова. От мышьяка и сурьмы олово очищают аналогично - добавкой алюминия, от свинца - с помощью SnCl2. Иногда висмут и свинец испаряют в вакууме. Чтобы получить металл сортовых марок (96,5...99,9 % Sn), используют огневое или реже электролитическое рафинирование. Необходимое полупроводниковой промышленности олово чистотой почти шесть девяток - 99,99985 % Sn - получают преимущественно методом зонной плавки.
Доля "вторичного" олова в промышленности развитых стран составляет примерно треть общего производства. В нашей стране работают около ста промышленных установок по регенерации олова. В переработку в основном идут отходы белой жести, используемые в пищевой промышленности (консервные банки). Чаще всего жесть обрабатывают газообразным хлором. Железо в отсутствие влаги с ним не реагирует. Олово соединяется с хлором очень легко. Образуется дымящаяся жидкость - хлорное олово SnCl4, которое применяют в химической и текстильной промышленности или отправляют в электролизер, чтобы получить там из него металлическое олово.
Физические свойства. В свободном состоянии при нормальных условиях олово - блестящий серебристо-белый мягкий (твердость по Бринеллю 38,3-41,2 Мн/м2 или 3,9-4,2 кгс/мм2) пластичный металл (может быть прокатан в очень тонкую фольгу - станиоль) с невысокой температурой плавления (231,9 oC) благодаря чему металл легко выплавляется из руд, однако у олова очень высокая температура кипения (2 270 oС). Олово довольно тяжелый металл с плотностью 7,31 г/см3, что меньше, чем у свинца (плотность11,34 г/см3) и тем более у благородных металлов (у золота плотность 19,3 г/см3, у платины 21,5 г/см3, у серебра 10,5 г/см3), однако сравнимо с железом (7,87 г/см3). Тем более, олово гораздо тяжелее алюминия (плотность 2,70 г/см3).
Как и многие другие элементы, олово полиморфно, то есть имеет несколько аллотропических модификаций (в переводе с греческого "аллотропия" означает "другое свойство", "другой поворот"). В обычных условиях оно существует в виде бета-модификации, так называемое белое олово, которое устойчиво при температурах выше 13,2 oC. Белое олово - это тот самый мягкий пластичный блестящий металл серебристо-белого цвета, обладающий тетрагональной элементарной ячейкой с параметрами a=0.5831, c=0.3181 нм. Координационное окружение каждого атома олова в нем - октаэдр.
Олово обладает низкой механической прочностью при комнатной температуре (предел прочности при растяжении 16,6 Мн/м2 или 1,7 кгс/мм2; относительное удлинение 80-90 %), то есть в бета-фазе (можно согнуть оловянную палочку, при этом будет слышен характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется. Однако оно легко образует сплавы с большинством других черных и цветных металлов. При охлаждении, особенно при морозе на улице, белое олово переходит в ?-модификацию - серое олово, которое имеет структуру алмаза (кубическая кристаллическая решетка с параметром а = 0,6491 нм).
В сером олове координационный полиэдр каждого атома - тетраэдр, координационное число которого 4. Фазовый переход начинается при температуре ниже 13,2 oC, происходит постепенная перестройка в кристаллической решетке оловянного слитка, при которой белое олово превращается в порошкообразное серое (?-олово), причем, чем ниже температура, тем больше скорость этого превращения. При ?33 oC скорость превращений становится максимальной, поверхность оловянного слитка покрывается трещинами, и металл превращается в порошок.
Удивительно, но соприкосновение серого олова и белого приводит к "заражению" последнего (катализатор - мышьяк). Совокупность этих явлений называется "оловянной чумой". Фазовый переход ?-олова в ?-олово сопровождается увеличением удельного объема на 25,6 %, что приводит к рассыпанию олова в порошок. Другая особенность фазовой смены заключается в изменении кристаллической решетки - кристаллы серого олова кубической конфигурации; размеры их элементарных ячеек больше (длина ребра 6,49 ?). Поэтому плотность серого олова заметно меньше, чем белого: 5,76 и 7,3 г/см3 соответственно. Из-за значительного различия структур двух модификаций олова разнятся и их электрофизические свойства. ?-олово – металл, в то время, как ?-олово относится к числу полупроводников. Ниже 3,72 К альфа-олово переходит в сверхпроводящее состояние.
Кроме белого и серого олова, обнаружена еще одна аллотропическая модификация пятидесятого элемента - ?-олово, устойчивое при температуре выше 161 oC. В этой фазе олово - очень хрупкий материал. Как типичный металл, с ростом температуры олово становится пластичнее, но только при температуре ниже 161 oC. Затем олово полностью утрачивает пластичность, происходит превращение в гамма-олово, металл становится настолько хрупким, что его можно истолочь в порошок.
Температурный коэффициент линейного расширения олова на отрезке температур от 0 до 100 oС составляет 23*10-6. Удельная теплоемкость при 0 oС 0,225 кдж/(кг*К), то есть 0,0536 кал/(г*oС), теплопроводность при той же температуре 65,8 вт/(м*К.), то есть 0,157 кал/(см*сек*oС). Удельное электрическое сопротивление олова при 20 oС равно 0,115*10-6 ом*м или 11,5*10-6 ом*см.
Химические свойства. При комнатной температуре олово, как и сосед по группе - германий, не взаимодействует с воздухом и водой. Дело в том, что на воздухе пятидесятый элемент покрывается тонкой оксидной пленкой, которая обладает защитным действием. Поэтому в условиях не сильного (анти-язва) коррозионного воздействия олово является химически стойким металлом. Заметное окисление олова на воздухе начинается при температурах выше 150 oC, при этом образуется диоксид олова:
Sn + O2 -> SnO2 (касситерит - оловянный камень)
Диоксид (или двуокись) олова встречается в природе (касситерит), а также может быть получен искусственно путем сжигания металла на воздухе или окислением его азотной кислотой с последующим прокаливанием полученного продукта. По материалам: http://www.i-think.ru
- Гетчеллит - "Нью-Альмаденская обманка" - арсенид и сульфид сурьмы (современная сульфосоль)
- Сурьма - ядовитый металл (полуметалл), широко используемый в металлургии, медицине и технике
- Цирконий - редкий и нераспространенный металл и опаснейший драгоценный камень в оксиде и соли
- Золото - желтый опасный и ядовитый металл современных точных цифровых и кабельных технологий
- Сера - золотисто-желтое токсическое вещество и признак активной вулканической деятельности
- Кадмий - нераспространенный токсический неизвестный широкому кругу людей серебристый металл
- Свинец - ядовитый серый имитатор металлического серебра и токсическая металлическая обманка
- Мышьяк - классический яд средневековых и современных отравителей и лекарство в медицине
Ядовитые и радиоактивные опасные камни и минералы
** - ядовитые камни и минералы (обязательная проверка в химлаборатории + явное указание на ядовитость)
** - радиоактивные камни и минералы (обязательная проверка на штатном дозиметре + запрет на открытые продажи в случае радиоактивности свыше 24 миллирентген / час + дополнительные меры защиты населения)
Каталог минералов и самоцветов мира по группам
** - ядовитые камни и минералы
** - радиоактивные камни и минералы
Created/Updated: 25.05.2018
 |
|