|
Начало раздела Производственные, любительские Радиолюбительские Авиамодельные, ракетомодельные Полезные, занимательные |
Хитрости мастеру Электроника Физика Технологии Изобретения |
Тайны космоса Тайны Земли Тайны Океана Хитрости Карта раздела |
|
| Использование материалов сайта разрешается при условии ссылки (для сайтов - гиперссылки) | |||
|
Навигация: => |
На главную / Каталог патентов / В раздел каталога / Назад / |
|
ИЗОБРЕТЕНИЕ
Патент Российской Федерации RU2019186
![]()
СПОСОБ ИНГИБИЦИИ ВИЧ-ИНФЕКЦИИ
Имя изобретателя: Быковский А.Ф.; Миллер Г.Г.; Покидышева Л.Н.; Титова И.В.; Артюков А.А.; Попов А.М.; Прозоровский С.В.; Лоенко Ю.Н.; Хесс Джозеф[US]; Еляков Г.Б.; Стоник В.А.; Исаков В.В.
Имя патентообладателя: Научно-исследовательский институт эпидемиологии и микробиологии им.Н.Ф.Гамалеи; Тихоокеанский институт биоорганической химии
Адрес для переписки:
Дата начала действия патента: 1991.02.28
Использование: в медицине, а именно для профилактики и лечения СПИДА и СПИД-ассоциированных заболеваний. Сущность: в способе используют низкомолекулярный сульфатированный полисахарид с мол. в. менее 20000 Дальтон с фукозой, сульфатированной по 4-му положению, остатки которой связаны гликозидными связями, и коррелируют с уроновами кислотами при соотношении 1 : 4 (SO3-FUC, UA=COOH) , при этом исходный продукт получают на водоросли ламинария японская. Положительный эффект: сульфатированный полисахарид низкого мол. в. не проявляет какой-либо токсичности для клеток ин витро в дозах свыше 5000 мкг/мг.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к медицине, а именно для профилактики и лечения СПИДа и СПИД-ассоциированных заболеваний.
Известен способ ингибиции ВИЧ-инфекции с помощью фукоидана.
Недостатком известного способа является то, что фукоидан обладает токсичностью.
Целью изобретения является снижение токсичности.
Данная цель достигается использованием низкомолекулярного сульфатированного полисахарида (НСП) с мол.в. около 15000 Дальтон, содержащего фукозу, сульфатированную по 4-му положению, остатки которой связаны гликозидными связями и коррелируют с уроновыми кислотами при соотношении 1:4 (SO3-FUC; UA-COOH), при этом исходный продукт получают из водоросли ламинария японская (Laminaria japonica).
НСП имеет следующие характеристики.
Физическая характеристика полисахарида. Материал и методы.
Хроматографический анализ был произведен на стеклянной колонке с гидрофобным сорбентом Полихром-1 и с сефакрилом S-300 (Фармациа, Швеция) с использованием детектора 1КВ UV-VIS (при 254 нм с 2 мл препаративной проточной клетки). Карбогидраты определяли фенольно-сернокислым методом.
Для анализа моносахаридов использовали жидкостную газовую хроматографию на хроматографе Свет-2 со стеклянной колонкой 2,5 х 0,4 см (3% OV-225 на хроматроне N-HMDS) при 150-230о, 5о/мин.
Образцы для анализа готовили гидролизом полисахаридного препарата при 90оС в течение 2 ч с 2N HCl с последующим получением перацетата альгитола обычным способом.
Спектр ядерного магнитного резонанса (Н и 13С ЯМР) определяли на спектрометре Bryker WM-250. Химические сдвиги регистрировали в ppm от тетраметилксилана.
Результаты.
НСП (МВ около 15000 Дальтон), белый аморфный порошок; [![]() ]27,825=13C
ЯМР(Д20); 102,4; 101,2; 100,7; 99,1 ppm (C-1) 13C ЯМР(Д2О); альгинат: 102,4; 101,2; 100,7(С-1) 71,2; 71,8;
66,0(С-2) 72,6; 72,8; 70,5(С-3) 79,2; 801,1(С-4) 772; 682(С-5) 176,1; 175,8; 175,6(С-6) фукоидан: 99,1(С-1) 74,9(С-2) 67,9(С-3) 81,3(С-4) 67,9(С-5)
17,2; 16,6(С-6).
]27,825=13C
ЯМР(Д20); 102,4; 101,2; 100,7; 99,1 ppm (C-1) 13C ЯМР(Д2О); альгинат: 102,4; 101,2; 100,7(С-1) 71,2; 71,8;
66,0(С-2) 72,6; 72,8; 70,5(С-3) 79,2; 801,1(С-4) 772; 682(С-5) 176,1; 175,8; 175,6(С-6) фукоидан: 99,1(С-1) 74,9(С-2) 67,9(С-3) 81,3(С-4) 67,9(С-5)
17,2; 16,6(С-6).
13С - ЯМР спектр определяли на спектрометре WM-250 (Bryker).
Таким образом, показано, что полисахаридная фракция является низкомолекулярным
компонентом с фукозой, сульфатированной по 4-му положению и ее остатки связаны ![]() -1,2-гликозидными
связями и коррелируют с уроновыми кислотами (маннуровой и гулуроновой) в соотношении 1:4
(SO3-FUC:UA-COOH).
-1,2-гликозидными
связями и коррелируют с уроновыми кислотами (маннуровой и гулуроновой) в соотношении 1:4
(SO3-FUC:UA-COOH).
Биологическая характеристика полисахарида.
П р и м е р 1. Ингибирующая активность НСП против адсорбции ВИЧ-1 и цитопатического
действия вируса определялась на клетках МТ4 следующим образом:
a) Прямой вируснейтрализующий эффект
1 мл суспензии ВИЧ-1, полученной после высокоскоростного центрифугирования
вируссодержащей культуральной жидкости из клеток Н9/ШВ или НТН1У27 и 1 мл раствора
НСП в соответствующих концентрациях (0,1 до 100 мгк/мл) помещали в пробирки и оставляли для
контакта на 2 ч при 37оС или комнатной температуре. После этого равные количества
клеток МТ4 предобработанных полибреном были добавлены в каждую пробирку для адсорбции
вируса с множественностью инфекции (МИ), равной 100, и оставляли для контакта при 37оС
на 1-1,5 ч.
После контакта клетки осаждали низкоскоростным центрифугированием в течение 10 мин, супернатант удаляли, клетки ресуспендировали в среде РРМ1 1640 с 10% фетальной телячьей сыворотки до конечной концентрации 2 х 105 кл/мл. Клеточную суспензию в количестве 1 мл распределяли в 24-луночные плато и культивировали при 37оС и 5% СО2 в течение 7 дней.
б) Ингибирующий эффект НСП на адсорбцию ВИЧ-1 на клетках МТ4.
По 2х105 кл/мл МТ4 распределяли в каждую лунку 24-луночных плато и после короткого периода оседания клеток на дне лунок вносили соответствующие концентрации НСП и преинкубировали при 37оС в течение 1 ч, после чего вносили вирусную суспензию с МИ-100 и культивировали клетки при тех же условиях 7 суток. Процент клеток, экспрессировавших и неэкспрессировавших вирусный антиген на поверхностной мембране вычисляли как среднее арифметическое трех повторностей от каждых 100 клеток в методе непрямой иммунофлуоресценции.
Соотношение Х адсорбции-ингибиции вируса, зависимое от концентрации НСП определяли по
следующей формуле, %:
![]() где a - антиген
положительных клеток в препаратах, обработанных НСП, %;
где a - антиген
положительных клеток в препаратах, обработанных НСП, %;
b - антиген положительных клеток в необработанных препаратах, %
100 - антиген положительных клеток в контрольных препаратах (см. табл. 1 и 2).
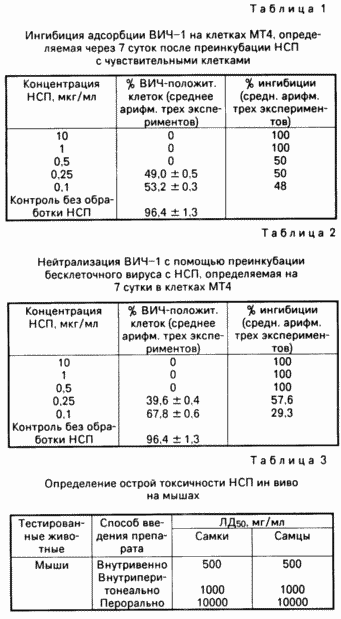
Антикоагуляционный эффект НСП был более чем в 10 раз ниже, чем у гепарина. Если 50% значение для анти-ВИЧ активности на клетках МТ4 (см. табл. 1 и 2) перевести из мкг/мл в ед/мл, получим следующие значения, ед/мл: НСП 6,7х10-3; фукоидан 3,6х10-3; гепарин 1 х 10-3.
Таким образом, НСП обладает анти-ВИЧ активностью при концентрациях более чем в 100 раз низких, чем его антикоагуляционная активность.
Определение ин виво и ин витро острой токсичности полисахаридной фракции НСП.
Определение острой токсичности ин виво проводили на белых мышах (по 10 животных в каждой группе), 4-5 недельного возраста, массой 21-24 г. НСП, разведенный в физиологическом растворе в соответствующих концентрациях, вводили животным тремя различными путями: внутривенно, внутриперитонеально, перорально. Ведущие симптомы, гибель и массу тела исследовали у каждого животного в течение 7-дневного периода наблюдения, после чего каждое животное забивали и подвергали анатомическому исследованию внутренние органы. Как показано в табл. 3, ни у одного животного, получавшего препарат одним из указанных способов, не было обнаружено никаких симптомов острой токсичности или каких-либо нарушений морфологии внутренних органов (см. табл. 4).
Цитотоксичность НСП ин витро на клетках МТ4 и Н9 не проявлялась даже при концентрациях препарата выше 5000 мкг/мл в сравнении с прототипным фукоиданом, для которого 50% цитотоксическая доза, определяемая по выживанию клеток МТ4, равна 1060 ± 210 мкг/мл или с азидотимидином (Сигма), который токсичен для клеток при концентрациях выше 1000 мкг/мл.
Таким образом, НСП может быть использован как в виде самостоятельной формулы, так и в качестве составного компонента фармацевтической композиции или в комбинации с другими известными препаратами, такими как АЗТ.
Ингибирующий эффект НСП на обратно транскриптазную активность ин витро определяли с
использованием вируса птичьего миелобластоза (АМВ) в качестве источника энзима (предоставлен
НИИ молекулярной биологии и генетики АН СССР, Киев). Тестирование проводили по
известному методу. 2 мг НСП растворяли в 1 мл стерильной дистиллированной воды и
доводили до соответствующих концентраций. 20 мл объем реакционной смеси состоял из:
50 мМ Трис-HCl, pH 8,2; 5 ![]() М MgCl2; 1
М MgCl2; 1 ![]() g
олиго (d АТР) РНК, рН 8,2 в качестве матрицы, 20
g
олиго (d АТР) РНК, рН 8,2 в качестве матрицы, 20 ![]() М dАТР, dСТР, dТТР и 0,5
М dАТР, dСТР, dТТР и 0,5
![]() Ki 3H-dСТР; 60
Ki 3H-dСТР; 60 ![]() М
KCl, 1
М
KCl, 1 ![]() М
М ![]() -меркаптоэтанола
и помещали в 1,5 мл пробирки Эппендорф, которые помещали в водяную баню при 37оС на 5
мин. После этого 20 мкл ранее приготовленного раствора НСП соответствующих
концентраций добавляли в реакционную смесь вместе с 1 мкл обратной транскриптазы АМВ и
оставляли для взаимодействия при 37оС на 1 ч. После этого реакционную смесь
переносили на мембранные фильтры ДЕ-81, промывали 5 раз с 5-минутными перерывом при
встряхивании, высушивали и помещали в стеклянные контейнеры, содержащие по 10 мл
жидкого сцинтилляционного коктейля. Радиоактивность (с.р.м.) каждого фильтра
подсчитывали за 1 мин в сцинцилляционном счетчике. Уровень ингибиции обратно
транскриптазной активности (ИТА) подсчитывали по формуле
-меркаптоэтанола
и помещали в 1,5 мл пробирки Эппендорф, которые помещали в водяную баню при 37оС на 5
мин. После этого 20 мкл ранее приготовленного раствора НСП соответствующих
концентраций добавляли в реакционную смесь вместе с 1 мкл обратной транскриптазы АМВ и
оставляли для взаимодействия при 37оС на 1 ч. После этого реакционную смесь
переносили на мембранные фильтры ДЕ-81, промывали 5 раз с 5-минутными перерывом при
встряхивании, высушивали и помещали в стеклянные контейнеры, содержащие по 10 мл
жидкого сцинтилляционного коктейля. Радиоактивность (с.р.м.) каждого фильтра
подсчитывали за 1 мин в сцинцилляционном счетчике. Уровень ингибиции обратно
транскриптазной активности (ИТА) подсчитывали по формуле
ИТА = ![]() x 100, %, где Со -
контрольная радиоактивность образца без НСП;
x 100, %, где Со -
контрольная радиоактивность образца без НСП;
Cs - радиоактивность образца после преинкубации с НСП.
Уровень ингибиции ОТ активности показан на чертеже.
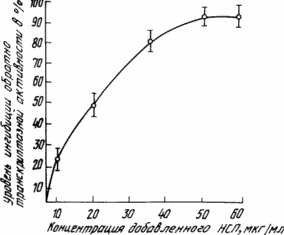
Таким образом, сульфатированный полисахарид низкого мол.в. не проявляет какой-либо токсичности для клеток ин витро в дозах свыше 5000 мкг/мл и лабораторных животных ин виво и может быть получен с помощью дешевой безотходной технологии путем обработки морской водоросли (Laminaria japonica).
ФОРМУЛА ИЗОБРЕТЕНИЯ
СПОСОБ ИНГИБИЦИИ ВИЧ-ИНФЕКЦИИ путем применения сульфатированного полисахарида, отличающийся тем, что, с целью снижения токсичности, используют низкомолекулярный сульфатированный полисахарид с мол.м. менее 20000 Дальтон, с фукозой, сульфатированной по 4-му положению, остатки которой связаны гликозидными связями и коррелируют с уроновыми кислотыми при соотношении 1 : 4 (SO3 - FUC; UA - COOH), при этом исходный продукт получают из водоросли Ламинария японская (Laminaria japonica).
Версия для печати
Дата публикации 06.01.2007гг
Created/Updated: 25.05.2018
 |
|
