|
Начало раздела Производственные, любительские Радиолюбительские Авиамодельные, ракетомодельные Полезные, занимательные |
Хитрости мастеру Электроника Физика Технологии Изобретения |
Тайны космоса Тайны Земли Тайны Океана Хитрости Карта раздела |
|
| Использование материалов сайта разрешается при условии ссылки (для сайтов - гиперссылки) | |||
|
Навигация: => |
На главную / Каталог патентов / В раздел каталога / Назад / |
|
ИЗОБРЕТЕНИЕ
Патент Российской Федерации RU2211698
![]()
МОДУЛЯЦИЯ ИММУННОГО ОТВЕТА С ПОМОЩЬЮ РИБАВИРИНА
Имя изобретателя: ТЭМ Роберт (US)
Имя патентообладателя: АЙ-СИ-ЭН ФАРМАСЬЮТИКАЛЗ, ИНК. (US)
Адрес для переписки: 193036, Санкт-Петербург, а/я 24, "НЕВИНПАТ", Поликарпову А.В.
Дата начала действия патента: 1999.12.20
Изобретение относится к медицине, в частности к иммунологии, и касается разработки путей иммуномодуляции с помощью нуклеотидов. Для этого ответ иммунной системы на стимул модифицируют путем представления системе нуклеозида в концентрации, выбранной таким образом, чтобы оказывать воздействие на В7 молекулярный маркер, которое является обратным воздействию стимула. Рассматриваемые стимулы включают в себя аллергены, новообразование, вирус, бактерии, паразитарную инвазию и аутоиммунную реакцию. Особенно важными для этого молекулярными маркерами считают В7-1 и В7-2. Предпочтительными нуклеозидами являются рибавирин и аналоги рибавирина. Способ обеспечивает повышение иммунокорригирующего эффекта при различных заболеваниях.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Областью настоящего изобретения является иммунология.
В дополнение к обычно используемым физиологическим и фенотипическим диагностическим параметрам заболевания иногда могут быть скоррелированы с молекулярными маркерами, такими как полидность (polidy), мутации в специфических генах, проявление определенных маркеров клеточной поверхности и так далее. Многие из этих маркеров действуют как специфичные для заболевания прогностические показатели или признаки и могут, таким образом, быть использованы как диагностические средства для точного определения физиологического состояния.
В последние годы было сделано много попыток скоррелировать относительно сложные заболевания, такие как аутоиммунная реакция, астма, рак и так далее, со специфическими молекулярными маркерами. В нескольких исследованиях была выявлена прямая или косвенная вовлеченность костимуляторных молекул В7-1 и В7-2 в модулирование иммунной системы при заболеваниях. Однако, несмотря на многочисленные подробные данные о различных уровнях экспрессии В7-1 и В7-2 при заболеваниях, полученные в результате таких исследований, всеобъемлющая и полная картина так и не создана (Hepatology 25, No. 5, 1997, pp. 1108-1114: Expression of costimulatory molecules B7-1 and B7-2 and human hepatocellular carcinoma; J. Cancer. Res. Clin. Oncol. 124, 7, 1998, pp.383-388: Expression of costimulatory molecules B7-1 and B7-2 on human gastric carcinoma; J. Neuroimmunol. 84, 2, 1998, р.179-187: Costimulatory CD80 (B7-1) and CD86 (B7-2) on cerebrospinal fluid cells in multiple sclerosis; J. Neuroimmunol. 91, No. 1-2, 1998, pp.198-203: B7-1 (CD80), B7-2 (CD86), interleukin-12 and transforming growth factor-beta mRNA expression in CSF and peripheral blood mononuclear cells from multiple sclerosis patients).
Во многих случаях наблюдали явно противоречивые корреляции между B7-1, B7-2 и специфическими заболеваниями (см. табл.1). При некоторых типах рака, например, В7-1 присутствует в относительно высоких количествах, а В7-2 присутствует в относительно малых количествах. При других типах рака 87-1 и В7-2 имеют совершенно обратную корреляцию (J. Cancer Res. Clin. Oncol. 124, 7, 1998, p.383-388: Expression of costimulatory molecules B7-1 and B7-2 on human gastric carcinoma; Br. J. Haematol. 102, No.5, 1998, р.1257-1262: The expression of costimulatory molecules and their relationship to the prognosis of human acute myeloid leukemia: poor prognosis of B7-2 positive leukemia; Int. J. Mol. Med. 2, 2, 1998, р.167-171: Lack of B7-1 and B7-2 on head and neck cancer cells and possible significance for gene therapy).
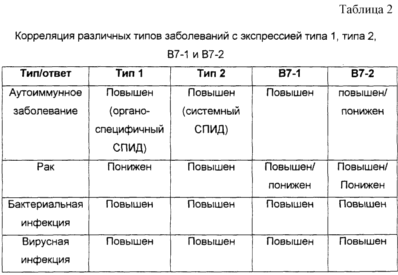
Экспрессия B7-1 и B7-2 и демонстрирует только противоречивую корреляцию с моделями известных цитокинов (см. табл.2). Например, была установлена корреляция повышенной экспрессии B7-1 как с позитивной, так и с негативной регуляцией ответа типа 1, а и была установлена корреляция В2-7 как с позитивной, так и с негативной регуляцией ответа типа 1. То же самое можно сказать о корреляции B7-1 и B7-2 с ответом типа 2 (см. табл.1) (Am. J. Respir. Cell Mol. Biol. 17, No.2, 1997, p.235-242: Differential regulation of human, antigen-specific Type 1 and Type 2 responses by the B-7 homologues CD80 and CD86; J. Immunol. 156, No.8, 1996, p.2387-2391: Costimulation of IL-4 production by murine B7-1 and B7-2 molecules.).
Далее, еще неясно, какие лекарства или даже категории лекарств были бы эффективны в модулировании активности B7-1 или B7-2, и даже если такие лекарства и были бы идентифицированы, остается неясным, как с пользой использовать такие костимуляторные молекулы для модулирования иммунной системы. Учитывая в совокупности все эти неизвестные, сохраняется существенная необходимость в создании способов и композиций для модулирования одного или более чем одного В7 маркера, особенно как средства влияния на ответ иммунной системы на данный стимул.
Краткое описание таблиц
Табл. 1 представляет собой таблицу,
сопоставляющую специфические заболевания
и их корреляцию с экспрессией B7-1 и B7-2.
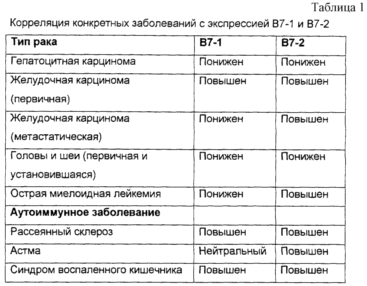
Табл. 2 представляет собой таблицу, сопоставляющую различные типы заболеваний с экспрессией типа 1, типа 2, B7-1 и B7-2.
Сущность изобретения
Это изобретение предлагает способы и
композиции, посредством которых
модифицируют ответ иммунной системы на
стимул. В общем ответ модифицируют,
представляя в систему нуклеозид в
концентрации, выбранной так, чтобы
оказывать на В7 маркер воздействие,
обратное воздействию стимула.
В одном аспекте предпочтительных воплощений стимулы выбраны из групп, состоящих из аллергенов, новообразования, вируса, бактерий, инвазии и аутоиммунной реакции. Особенно интересными молекулярными маркерами являются В7-1 и В7-2. В другом аспекте предпочтительных воплощений нуклеозид является аналогами рибавирина, а в особенно предпочтительных воплощениях нуклеозид является рибавирином. В еще одном аспекте предпочтительных воплощений обеспечивается количество нуклеозида, достаточное для достижения диапазона концентраций между приблизительно 0,2:М и приблизительно 5:М соответственно, в текучей среде, содержащей клетки, экспрессирующие В7 маркер.
В еще одном аспекте предпочтительных воплощений стимул скоррелирован с увеличением ответа типа 2, и использование нуклеозида скоррелировано с уменьшением ответа типа 2.
Подробное описание конкретных воплощений
Автор изобретения обнаружил, что
существует поразительная связь между
определенными нуклеозидами, особенно
рибавирином и его аналогами, и экспрессией
одного или более чем одного В7 маркера.
Дальнейшие исследования выявили другую
неожиданную связь - что применение таких
нуклеозидов может быть использовано для
благоприятного воздействия на результат
заболевания или другого стимула. В
частности, был обнаружен способ
модулирования ответа иммунной системы на
стимул, при котором: (а) коррелируют стимул с
воздействием на В7 маркер; (б) коррелируют
применение нуклеозида в пределах диапазона
концентраций с модуляцией В7 молекулярного
маркера, которая является обратной этому
воздействию; и (в) представляют иммунной
системе нуклеозид в пределах этого
диапазона концентраций.
Используемый здесь термин "нуклеозид" относится к соединению, состоящему из любой пентозной или модифицированной пентозной группировки, присоединенной к определенному положению гетероцикла или к естественному положению пурина (9-положение) или пиримидина (1-положение), или к эквивалентному положению в аналоге, включая, в частности, D- и L-формы азотных бициклических и моноциклических гетероциклов. Термин "D-нуклеозиды" относится к нуклеозидным соединениям, которые имеют D-рибозную сахарную группировку (например, аденозин). Термин "L-нуклеозиды" относится к нуклеозидным соединениям, которые имеют L-рибозную сахарную группировку. Термин "нуклеотид" означает нуклеозиды, в которых фосфатные эфиры замещают по 5' положению нуклеозида.
Термин "фармацевтически приемлемые соли" относится к любой соли, полученной из неорганических или органических кислот или оснований.
Термин "новообразование" относится к любому виду автономного патологического роста ткани, который может стать, а может и не стать злокачественным, включая любой вид опухолей и раков.
Термины "лечение" или "терапия" заболевания относятся к выполнению протокола, который может включать в себя введение одного или более чем одного лекарства пациенту для облегчения признаков или симптомов заболевания. Таким образом, "лечение" или "терапия" не требует полного снятия признаков или симптомов, не требует выздоровления и конкретно включает в себя протоколы, которые оказывают только маргинальное действие (такое как эффект плацебо) на пациента.
Используемый здесь термин "иммунная система" обозначает любую совокупность иммунокомпетентных клеток, которые коллективно идентифицируют и атакуют чужеродные объекты и которые динамически реагируют на новые патогены или другие стимулы. Примерами иммунной системы являются иммунные системы человека или других млекопитающих, которые включают в себя селезенку, В-лимфоциты тимуса, Т-лимфоциты и антитела. Иммунная система, как определено здесь, должна иметь клеточный компонент, но может иметь или не иметь гуморальный компонент. Когда гуморальный компонент включен в иммунную систему, этот гуморальный компонент может включать в себя растворимые молекулы, секретируемые из иммунокомпетентных клеток, включая антитела или интерлейкины. Примерами растворимых молекул являются IgG, IgM, IgE или ИЛ2, ИЛ4, ИЛ 10 (интерлейкин 2, 4, 10).
Согласно этому определению считают, что цельная кровь, а и кровь, обедненная по фибриногену, тромбоцитам и эритроцитам, содержит иммунную систему, так как она содержит иммунокомпетентные клетки, которые способны динамически реагировать на новые патогены. Другими иммунными системами являются среды для культивирования клеток, содержащие иммунокомпетентные клетки. Напротив, забуференный раствор антител не считают иммунной системой, так как он не содержит множества иммунокомпетентных клеток. В других воплощениях человек или другие животные содержат иммунные системы, как определено здесь.
Термин "стимул" используют здесь для обозначения любого компонента или события, которые вызывают ответ иммунной системы. Стимулы могут быть сгруппированы в три категории: собственные, несобственные и измененные собственные стимулы. Стимулы собственного типа включают в себя клетки или молекулы, причем иммунная система и эти стимулы происходят из одного и того же организма, собственные белки или аутологичные белки и их фрагменты. Примеры включают в себя клетки крови человека, недифференцированные клетки, антитела или коагулирующие факторы одного и того же человека. Стимулы несобственного типа включают в себя клетки, вирусы или молекулы, причем иммунная система и этот стимул происходят от разных организмов, или стимул является ксеногенным. Примеры включают в себя органы или клетки от неидентичного донора, бактерии, вирусы или любой тип молекул, типичный для других видов, включая эндотоксины, ферменты или структурные белки. Стимулы измененного собственного типа включают в себя клетки или молекулы, причем иммунная система и этот стимул происходят от одного и того же организма, но при этом стимул подвергнут модификациям, деградационным или неопластическим изменениям. Примеры таких модификаций включают в себя модифицирование профиля В7 маркера или представляющих антиген клеток. Примеры деградационных изменений включают в себя клетки, подвергшиеся апоптозу, или некротическую ткань. Примеры неопластических изменений включают в себя индукцию рака.
Термины "ответ иммунной системы" и "иммунный ответ" используют здесь для обозначения любого ответа иммунной системы на стимул. Особенный интерес в этом приложении представляют иммунные ответы, которые включают в себя модуляцию В7 маркера. Такая модуляция может включать в себя любую комбинацию повышения или понижения экспрессии В7-1 и В7-2. Таким образом, все ответы, представленные в табл. 1 и 2, являются примерами рассматриваемых ответов иммунной системы.
Другие рассматриваемые ответы иммунной системы включают в себя вовлечение клеточных компонентов в специфические клеточные взаимодействия или изменения в генетической активности. Клеточные специфические взаимодействия могут быть взаимодействиями клетка-клетка или взаимодействиями клетка-стимул. Примерами взаимодействий клетка-клетка являются Т-хелперные клетки, контактирующие с Т- клетками, или Т-хелперные клетки, контактирующие с макрофагами. Примерами взаимодействий клетка-стимул являются антиген-представляющие клетки, инкорпорирующие стимул, процессирующие этот стимул и выставляющие процессированный стимул на клеточной поверхности, или В-клетки, выставляющие стимул-специфические антитела на своей клеточной поверхности и связывающие стимул с антителом. Изменения в генетической активности могут представлять собой реаранжировки в геномной ДНК или селективную активацию генов. Примерами реаранжировок в геномной ДНК являются сплайсинговые события, приводящие к "созреванию афинности" антител против стимула, или сплайсинговые события, приводящие к переключению класса между различными классами антител. Примерами селективной активации генов являются повышение или понижение транскрипции или трансляции генов, кодирующих интерлейкины или В7-1 или В7-2.
Как оно использовано здесь, продуцирование В7 воздействия, которое является "обратным" воздействию, ассоциированному со стимулом, означает, что это В7 воздействие, производимое одним нуклеозидом, является по меньшей мере маргинальным в направлении, противоположном воздействию, ассоциированному только с одним стимулом. Таким образом, если стимул ассоциирован с пониженной экспрессией В7-1, обратное В7 воздействие будет представлять собой воздействие, при котором В7-1 будет по меньшей мере маргинально повышенным. Подобным же образом, если стимул ассоциирован с повышенной экспрессией В7-2, обратное В7 воздействие будет представлять собой воздействие, при котором В7-2 будет по меньшей мере маргинально пониженным.
Использованный здесь термин "представление иммунной системе нуклеозида" означает, что нуклеозид контактирует с некоторым компонентом иммунной системы в степени, достаточной для продуцирования ответа иммунной системы. В предпочтительных воплощениях это означает добавление нуклеозида к телу. В других воплощениях это означает добавление нуклеозида в сосуд или другой контейнер для иммунной системы.
Должно быть понято, что определение термина "представление иммунной системе нуклеозида" достаточно широко с тем, чтобы включать в себя любую комбинацию контакта m-vivo, in-vitro или ex-vivo. In- vivo может включать в себя инъекцию, прием внутрь, чрескожную доставку или ингаляцию. Примерами различных инъекций являются внутримышечная, внутривенная или подкожная инъекция. Примерами различных форм для приема внутрь являются таблетки, сиропы или порошки. С помощью окклюзионных повязок, мазей или электрофоретических методов можно достичь трансдермальной доставки. Ингаляция может быть осуществлена методами испарения или распыления.
Контактирование in-vitro может быть достигнуто либо путем дозирования раствора, содержащего нуклеозид, в иммунную систему в подходящем сосуде, либо путем растворения нуклеозида в растворе, который может быть, а может не быть частью иммунной системы. Примеры дозирования включают в себя автоматическое или ручное пипетирование, капанье, выливание или инъецирование раствора, содержащего нуклеозид, в иммунную систему. Альтернативно, нуклеозид может и быть растворен в текучей среде путем перемешивания, смешивания или выливания рибавирина в текучую среду. Эта текучая среда может содержать иммунную систему или может являться раствором-носителем, включая буферные, изотонические растворы, кровь. Этот носитель может затем быть дозирован в иммунную систему.
Ex-vivo контактирование может быть достигнуто в несколько стадий, при которых (1) отбирают часть иммунной системы от источника, (2) вводят нуклеозид в иммунную систему и (3) возвращают иммунную систему по меньшей мере частично источнику. Отбор части иммунной системы может быть выполнен путем изъятия части иммунной системы из in-vivo или in-vitro источника. Примерами источников in vivo являются позвоночные животные, включая человека, и беспозвоночные животные. Изъятие может быть проведено с помощью венопункции, глазного кровоизвлечения или уколов.
Примерами источников in-vitro являются культуры клеток, содержащие иммунную систему, обработанная или консервированная кровь. Изъятие может быть проведено с помощью любых средств для переноса текучих сред, например автоматическим или ручным пипетированием, аспирацией, капаньем и так далее. Возвращение иммунной системы источнику может быть проведено с помощью любых средств для переноса текучих сред. В случае in vitro источника это может быть автоматическое или ручное пипетирование, аспирация, капанье, а в случае in vivo источника - внутривенное инъецирование.
Рассматриваемые нуклеозиды представляют собой рибавирин (1-b-D-рибофуранозил-1,2,4-триазол-3-карбоксамид) и его аналоги. Для внесения ясности аналоги рибавирина означают любое производное рибавирина, в котором (1) одна или более чем одна гидроксильная группа заменена негидроксильной группировкой, имеющей менее 25 атомов, включая Н, низший алкил, низший арил, низший аралкил, низший алкил-алкенил, галоген и так далее, и независимо один или более чем один водород заменен неводородной группировкой, имеющей менее 25 атомов, включая ОН, низший алкил, низший арил, низший аралкил, низший алкилалкенил, галоген и так далее.
Рибавирин, аналог рибавирина или другой нуклеозид предпочтительно приготовлен в виде препарата в буферном водном растворе. В альтернативных воплощениях, однако, нуклеозид может быть приготовлен в виде препарата в многочисленных других жидких или твердых формах. Жидкие формы могут представлять собой растворы, содержащие чистые растворители, включая воду, ДМСО (диметилсульфоксид) или этанол. Жидкие формы могут и содержать растворы, включающие в себя смеси растворителя с другими растворителями или растворенные твердые вещества, включая водноэтанольные смеси, смеси вода-ДМСО, буферы. Далее, жидкие формы нуклеозидов могут быть смешаны, например, с модифицирующими консистенцию веществами для образования гелей, кремов или мазей. Примерами являются амфифильные молекулы, воски или желатин. Твердые формы могут содержать твердые вещества, которые могут являться, а могут и не являться активными ингредиентами. Примерами активных ингредиентов являются буферы, ионообменные смолы, включая МОПС ((3-(N-морфолино)пропансульфоновая кислота), фосфаты или цитраты. Примеры неактивных ингредиентов включают в себя крахмал, целлюлозу или диоксид кремния. Далее, твердые формы могут находиться в составе различных препаратов, включая таблетки, капсулы, порошки и так далее.
В предпочтительных воплощениях берут количество нуклеозида, достаточное для достижения диапазона концентраций между приблизительно 0,2:М и приблизительно 5: М соответственно, в текучей среде, содержащей клетки, экспрессирующие В7 маркер. Менее предпочтительные воплощения охватывают другие концентрации в диапазоне от 0,1 мкМ до приблизительно 10 мкМ.
В другом аспекте предпочтительных воплощений стимул скоррелирован с усилением ответа типа 2, а применение нуклеозида скоррелировано с ослаблением ответа типа 2. Ответ типа 2 может быть понят следующим образом.
Иммунные системы млекопитающих содержат два основных класса лимфоцитов: В-лимфоциты (В-клетки), которые происходят из костного мозга, и Т-лимфоциты (Т- клетки), которые происходят из тимуса, В-клетки в основном ответственны за гуморальный иммунитет (то есть продуцирование антител), в то время как Т-клетки в основном ответственны за опосредованный клетками иммунитет. Т-клетки в общем разделяют на два подкласса, хелперные Т-клетки и цитотоксичные Т-клетки. Хелперные Т-клетки активируют другие лимфоциты, включая В-клетки и цитотоксичные Т-клетки, и макрофаги, путем высвобождения растворимых белковых медиаторов, называемых цитокинами, которые вовлечены в опосредованный клетками иммунитет. Как они используются здесь, лимфокины являются субпопуляцией цитокинов.
В общем и считают, что хелперные Т-клетки и разделяются на два подкласса, тип 1 и тип 2. Клетки типа 1 (так же известные как Тh1 клетки) продуцируют интерлейкин 2 (ИЛ-2), фактор некроза опухоли (ФНО-a) и интерферон гамма (ИФН-U) и являются главным образом ответственными за опосредованный клетками иммунитет, такой как гиперчувствительность замедленного типа и антивирусный иммунитет. Напротив, клетки типа 2 (так же известные как Th2 клетки) продуцируют интерлейкины ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-10 и ИЛ-13, и вовлечены в содействие гуморальным иммунным ответам, таким как ответы, получаемые в ответ на аллергены, например переключение изотипа антител IgE и IgG4 (Mosmann, 1989, Annu. Rev. Immunol., 7:145-173).
Используемые здесь термины "ответы" типа 1 и типа 2 подразумевают включение всего спектра воздействий, являющихся результатом индукции лимфоцитов типа 1 и типа 2 соответственно. Среди прочего такие ответы включают в себя вариацию в продуцировании соответствующих цитокинов через транскрипцию, трансляцию, секрецию и возможно другие механизмы, повышенную пролиферацию соответствующих лимфоцитов и другие воздействия, ассоциированные с повышенной продукцией цитокинов, включая влияние на подвижность.
Как описано в патенте США 5767097 (Tarn, июнь 1998), описание которого включено сюда путем ссылки, любой ответ типа 1 и типа 2 может быть селективно подавлен, в то время как другой либо индуцирован, либо относительно не затронут, и любой из ответов типа 1 или типа 2 может быть селективно индуцирован, в то время как другой либо подавлен, либо относительно не затронут. Так же, как изложено в находящейся в процессе одновременного рассмотрения РСТ заявке на патент PCT/US98/00634, описание которой включено сюда путем ссылки, некоторые нуклеозиды, такие как рибавирин, являются эффективными в селективном модулировании ответов типа 1 и типа 2 относительно друг друга. Определение того, какие нуклеозиды являются эффективными в понижении ответа типа 2, легко осуществляется экспериментальным путем.
Полагают, что описанные здесь способы могут быть использованы для лечения широкого ряда заболеваний, фактически любого заболевания, которое благоприятно реагирует на такое лечение. Среди прочего конкретно полагают, что такие комбинации могут быть использованы для лечения аллергена (аллергии), новообразования (рака), вирусов (вирусной инфекции) бактерий (бактериальной инфекции), инвазии или аутоиммунного заболевания.
Инфекции, предполагаемые для лечения нуклеозидами по настоящему изобретению, включают в себя респираторосинцитиальный вирус (respiratory syncytial virus, RSV), вирус гепатита В (HBV), вирус гепатита С (HCV), простой герпес типа 1 и типа 2, генитальный герпес, герпетический кератит, герпетический энцефалит, опоясывающий герпес, вирус иммунодефицита человека (ВИЧ), вирус гриппа А, ксантанн-вирус (геморрагической лихорадки), вирус папилломы человека (ВПЧ), корь и грибок. В частности, полагают, что заявленные здесь комбинации будут полезны в лечении хронических вирусных и бактериальных инфекций, включая ВИЧ, туберкулез, лепру и так далее.
Инвазии, предполагаемые для лечения нуклеозидами по настоящему изобретению, включают в себя внутриклеточные инвазии простейших, а и гельминтные и другие паразитарные инвазии. Опять же, в частности, полагают, что комбинации, заявленные здесь, будут полезны в лечении хронических инвазий.
Новообразования, предполагаемые для лечения, включают в себя новообразования, вызванные вирусом, и эффект может включать в себя ингибирование трансформации инфицированных вирусом клеток в неопластическое состояние, ингибирование распространения вирусов из трансформированных клеток в другие нормальные клетки и/или прекращение роста трансформированных вирусом клеток.
Аллергии, предполагаемые для лечения, включают в себя все IgE и IgG аллергии, гипер-IgE синдром и дерматические состояния, такие как атопический дерматит. и полагают, что заявленные способы могут быть использованы для лечения отторжения трансплантата (заболевание трансплантат против хозяина) и реакций имплантата.
Аутоиммунные заболевания могут быть классифицированы как неорганоспецифические или органоспецифические. Неорганоспецифические аутоиммунные заболевания включают в себя ревматоидный артрит, подагру и подагрический артрит, системную красную волчанку (СКВ), синдром Шегрена, склеродерму, полимиозит и дермомиозит, анкилозирующий спондилоартрит и ревматическую лихорадку. Органоспецифические аутоиммунные заболевания известны для практически любого органа, включая инсулинозависимый диабет, заболевания щитовидной железы (болезнь Грейвса и тиреоидит Хашимото), болезнь Аддисона и некоторые заболевания почек и легких, включая аллергию и астму, рассеянный склероз, тяжелую псевдопаралитическую миастению, увеит, псориаз, формы гепатита и цирроза, болезнь глютеновой недостаточности, воспалительное заболевание кишечника, и некоторые типы мужского и женского бесплодия. Аутоиммунные процессы могут и быть простимулированы вирусными инфекциями, включая ВИЧ вирус, могут являться результатом отторжения трансплантата и могут сопровождать некоторые опухоли, или быть ускорены под воздействием некоторых химикатов.
Синтез
Синтез рибавирина хорошо известен, а синтез
аналогов рибавирина становится очевидным
из материалов заявок PCT/US97/18387 и PCT/US97/00600,
описание обоих включено сюда путем ссылки.
Введение
Предполагается, что нуклеозиды в
соответствии с настоящим изобретением
вводят в составе любого подходящего
фармацевтического препарата и по любому
подходящему протоколу. Предпочтительные
дозировки и протоколы, очевидно, лучше
всего устанавливать на основании
экспериментов с конкретными пациентами.
Такие эксперименты не должны быть
обширными, и предполагается, что нуклеозиды
вводят человеку в диапазоне между
приблизительно 100 мг/сут и приблизительно
5000 мг/сут. Полагают, в частности, что
человеку и другим системам рибавирин или
другой нуклеозид следует доставлять при
параметрах, которые создают концентрацию
нуклеозида в текучей среде, содержащей
клетки, экспрессирующие В7, между
приблизительно 0,2:М и приблизительно 5:М
соответственно.
Конечно, когда лечение касается заболевания, специалист понимает, что терапевтически эффективное количество будет варьировать в зависимости от инфекции или состояния, подлежащего лечению, его тяжести, применяемого режима лечения, фармакокинетики используемого агента, а и от подлежащего лечению пациента (животного или человека). Таким образом, эффективные дозировки могут изменяться от 1 мг/кг массы тела или менее до 25 мг/кг массы тела или более. В общем считается, что терапевтически эффективное количество "второго" лекарства варьирует от немногим менее чем приблизительно 1 мг/кг до приблизительно 25 мг/кг пациента в зависимости от используемого нуклеозида, излечиваемого состояния или инфекции и пути введения. Этот диапазон дозировок обычно обеспечивает эффективные уровни концентрации активного нуклеозида в крови, варьирующие от приблизительно 0,04 до приблизительно 100 мкг/см3 крови у пациента. Предполагается, однако, что подходящий специфический для пациента режим будет разработан путем введения малого количества, а затем увеличения количества до тех пор, пока либо побочные эффекты станут чрезмерно неблагоприятными, либо будет достигнут желаемый эффект.
Введение нуклеозидов по настоящему изобретению может производиться перорально, парентерально (включая подкожные инъекции, внутривенную, внутримышечную, надчревную инъекцию или способы инфузии), с помощью ингаляционного аэрозоля или ректально, местно и так далее, и в препаратах стандартной дозы, содержащих традиционные нетоксические фармацевтически приемлемые носители, адъюванты и наполнители.
Полагают, что нуклеозиды по настоящему изобретению могут быть изготовлены в виде препаратов в смеси с фармацевтически приемлемым носителем. Например, нуклеозиды по настоящему изобретению могут быть введены перорально как фармакологически приемлемые соли. Поскольку нуклеозиды по настоящему изобретению обычно водорастворимы, они могут быть введены внутривенно в физиологическом солевом растворе (например, забуференном до рН от приблизительно 7,2 до 7,5). С этой целью могут быть использованы общепринятые буферы, такие как фосфаты, бикарбонаты или цитраты. Конечно, специалист может модифицировать препараты в пределах указаний данного описания для получения многочисленных препаратов для конкретного пути введения без придания композициям по настоящему изобретению нестабильности или снижения их терапевтической активности. В частности, модификация представленных нуклеозидов для превращения их в более растворимые в воде или другом носителе, например, может быть легко осуществлена путем небольших модификаций (образование солей, этерификация и так далее), которые хорошо известны специалистам. и хорошо известно специалистам, как модифицировать путь введения и режим дозирования конкретных нуклеозидов для изменения фармакокинетики рассматриваемых нуклеозидов для получения максимального благоприятного эффекта у пациентов.
В некоторых фармацевтических лекарственных формах предпочтительными является форма вводимого нуклеозида в виде пролекарства, особенно включая ацилированные (ацетилированные или другие) производные, пиридиновые эфиры и различные солевые формы настоящих нуклеозидов. Специалист знает, как быстро модифицировать представленные нуклеозиды в формы пролекарств для облегчения доставки активных нуклеозидов в сайт-мишень в пределах организма хозяина или пациента. Специалисту следует использовать преимущество благоприятных фармакокинетических параметров пролекарственных форм, когда это применимо, при доставке рассматриваемых нуклеозидов в целевой сайт в пределах организма хозяина для достижения максимального эффекта нуклеозида.
Кроме того, рассматриваемые нуклеозиды могут быть введены по-отдельности или вместе, и при этом раздельное введение может быть осуществлено в любом порядке. Количества активных ингредиентов и фармацевтически активных агентов и относительные режимы введения выбирают так, чтобы достигать желаемого комбинированного терапевтического эффекта.
Пути введения рассматриваемых нуклеозидов могут изменяться от непрерывного (капельное внутривенное вливание) до нескольких пероральных введений в сутки (например, четыре раза в день) и могут включать в себя, помимо других путей введения, пероральное, местное, парентеральное, внутримышечное, внутривенное, подкожное, трансдермальное (которое может включать в себя агент, улучшающий проникновение), трансбуккальное и суппозиторное введение.
При лечении по настоящему изобретению терапевтически эффективное количество нуклеозида предпочтительно однородно смешивают с фармацевтически приемлемым носителем согласно общепринятым фармацевтическим технологиям смешивания для получения дозы. Носитель может принимать широкий ряд форм в зависимости от формы препарата, желаемого для введения, например пероральной или парентеральной. При приготовлении фармацевтических композиций в пероральной лекарственной форме может быть использована любая обычная фармацевтическая среда. Так, для жидких пероральных препаратов, таких как суспензии, эликсиры и растворы, могут быть использованы подходящие носители и добавки, включая воду, гликоли, масла, спирты, корригенты, консерванты, красители и тому подобное. Для таких твердых пероральных препаратов как порошки, таблетки, капсулы, и для таких твердых препаратов как суппозитории, могут быть использованы подходящие носители и добавки, включая крахмалы, сахарный носитель, такой как декстроза, маннит, лактоза и родственные носители, разбавители, гранулирующие агенты, смазывающие агенты, связующие вещества, разрыхляющие агенты и тому подобное. При желании таблетки или капсулы могут быть покрыты энтеросолюбильной оболочкой или приготовлены в виде препарата пролонгированного высвобождения с помощью стандартных способов.
Носитель для парентеральных препаратов обычно содержит стерильную воду или водный раствор хлорида натрия, хотя могут быть включены другие ингредиенты, включая ингредиенты, способствующие диспергированию. Конечно, в тех случаях, когда следует использовать стерильную воду и поддерживать ее стерильность, композиции и носители должны и быть стерилизованы. Могут и быть приготовлены инъецируемые суспензии, и в этом случае могут быть использованы подходящие жидкие носители, суспендирующие агенты и тому подобное.
и следует понимать, что в целом наиболее предпочтительными применениями по настоящему изобретению являются те, в которых активные нуклеозиды относительно менее цитотоксичны по отношению к нецелевым клеткам хозяина и относительно более активны против цели. В этом отношении может и быть полезным то, что L-нуклеозиды могут обладать повышенной стабильностью относительно D-нуклеозидов, что может привести к улучшению фармакокинетики. Этот результат может достигаться в силу того, что L-нуклеозиды могут не распознаваться ферментами и таким образом могут иметь более продолжительный период полураспада.
Таким образом, описаны способы, при которых применяют рибавирин или другие нуклеозиды для благоприятного модулирования В7 молекулярного маркера. В то время, как здесь описаны конкретные воплощения, объем изобретения не ограничен ничем, кроме интерпретации формулы изобретения.
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Способ модулирования ответа иммунной системы на стимул, при котором устанавливают зависимость между стимулом и воздействием на В7 маркер, устанавливают зависимость между применением нуклеозида в пределах диапазона концентраций и модуляцией В7 молекулярного маркера, которая является обратной этому воздействию, и представляют иммунной системе нуклеозид в пределах этого диапазона концентраций.
2. Способ по п. 1, где стимул представляет собой аллерген.
3. Способ по п. 1, где стимул представляет собой новообразование.
4. Способ по п. 1, где стимул представляет собой вирус.
5. Способ по п. 1, где стимул представляет собой бактерию.
6. Способ по п. 1, где стимул представляет собой паразитарную инвазию.
7. Способ по п. 1, где стимул представляет собой аутоиммунную реакцию.
8. Способ по любому из пп. 1-7, где молекулярный маркер представляет собой В7-1.
9. Способ по любому из пп. 1-8, где молекулярный маркер представляет собой В7-2.
10. Способ по любому из пп. 1-8, где нуклеозид является рибавирином.
11. Способ по любому из пп. 1-8, где нуклеозид является аналогом рибавирина.
12. Способ по п. 1, где стимул выбран из группы, состоящей из аллергена, микроба, новообразования, паразитарной инвазии и аутоиммунной реакции, молекулярный маркер представляет собой В7-1, а нуклеозид является рибавирином.
13. Способ по п. 1, где стимул выбран из группы, состоящей из аллергена микроба, новообразования паразитарной инвазии и аутоиммунной реакции, молекулярный маркер представляет собой В7-2, а нуклеозид является рибавирином.
14. Способ по п. 1, где стимул выбран из группы, состоящей из аллергена, микроба, новообразования, паразитарной инвазии и аутоиммунной реакции, молекулярный маркер представляет собой В7-1, а нуклеозид не является рибавирином.
15. Способ по любому из пп. 1-8, при котором дополнительно коррелируют стимул с повышением ответа типа 2, и коррелируют применение нуклеозида с понижением ответа типа 2.
Версия для печати
Дата публикации 02.04.2007гг
Created/Updated: 25.05.2018
 |
|
